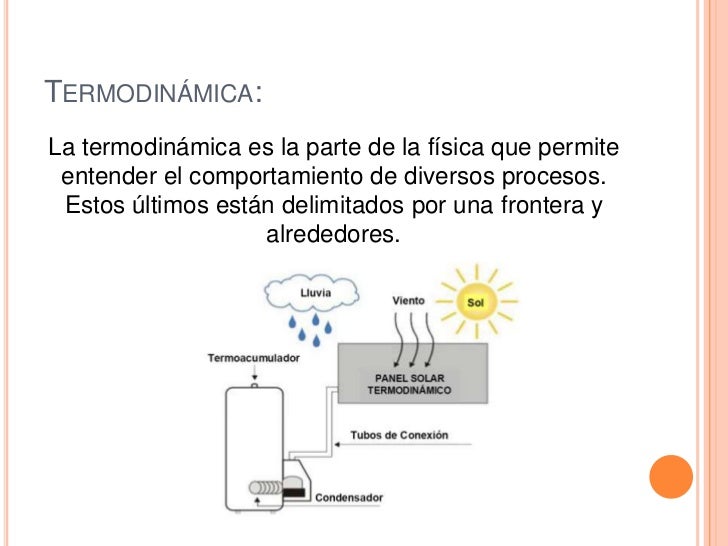
Cambios de estado
Si se calienta un sólido, llega un momento en que se transforma en líquido. Este proceso recibe el nombre de fusión. El punto de fusión es la temperatura que debe alcanzar una sustancia sólida para fundirse. Cada sustancia posee un punto de fusión característico. Por ejemplo, el punto de fusión del agua pura es 0 °C a la presión atmosférica normal.
Si calentamos un líquido, se transforma en gas. Este proceso recibe el nombre de vaporización. Cuando la vaporización tiene lugar en toda la masa de líquido, formándose burbujas de vapor en su interior, se denomina ebullición. También la temperatura de ebullición es característica de cada sustancia y se denomina punto de ebullición. El punto de ebullición del agua es 100 °C a la presión atmosférica normal.
Simulación: (pulsa el botón para encender el mechero y observa los cambios)
|
|
Transferencia de calor
La transferencia de calor es el paso de energía térmica desde un cuerpo de mayor temperatura a otro de menor temperatura. Cuando un cuerpo, por ejemplo, un objeto sólido o un fluido, está a una temperatura diferente de la de su entorno u otro cuerpo, la transferencia de energía térmica, también conocida como transferencia de calor o intercambio de calor, ocurre de tal manera que el cuerpo y su entorno alcancen equilibrio térmico. La transferencia de calor siempre ocurre desde un cuerpo más caliente a uno más frío, como resultado del segundo principio de la termodinámica. Cuando existe una diferencia de temperatura entre dos objetos en proximidad uno del otro, la transferencia de calor no puede ser detenida; solo puede hacerse más lenta.
Una barra al rojo vivo transfiere calor al ambiente principalmente porradiación térmica y en menor medida por convección, ya que la transferencia por radiación es 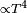 y la convección
y la convección 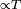 .
.
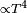 y la convección
y la convección 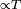 .
.MODOS DE TRANSFERENCIA
Los modos de transferencia son diferentes procesos de transporte de calor, usualmente se agrupan en tres tipos según haya también transferencia o no transferencia de materia (o fotones)como los siguientes :
- Conducción: Es la transferencia de calor que se produce a través de un medio estacionario -que puede ser un sólido- cuando existe una diferencia de temperatura.
- Convección: Se caracteriza porque se produce por medio de un fluido (líquido o gas) que transporta el calor entre zonas con diferentes temperaturas.
- La convección se produce únicamente por medio de materiales fluidos. Lo que se llama convección en sí, es el transporte de calor por medio del movimiento del fluido, por ejemplo: al trasegar el fluido por medio de bombas o al calentar agua en una cacerola, la que está en contacto con la parte de abajo de la cacerola se mueve hacia arriba, mientras que el agua que está en la superficie, desciende, ocupando el lugar que dejó la cacerola caliente.
- Radiación: se puede atribuir a cambios en las configuraciones electrónicas de los átomos o moléculas constitutivas. En ausencia de un medio, existe una transferencia neta de calor por radiación entre dos superficies a diferentes temperaturas, debido a que todas las superficies con temperatura finita emiten energía en forma de ondas electromagnéticas.
AISLAMIENTO Y BARRERAS DE RADIACIÓN
Los aislantes térmicos son materiales específicamente diseñados para reducir el flujo de calor limitando la conducción, convección o ambos. Las barreras de radiación, son materiales que reflejan la radiación, reduciendo así el flujo de calor de fuentes de radiación térmica. Los buenos aislantes no son necesariamente buenas barreras de radiación, y viceversa. Los metales, por ejemplo, son excelentes reflectores pero muy malos aislantes.
La efectividad de un aislante está indicado por su resistencia (R). La resistencia de un material es el inverso del coeficiente de conductividad térmica (k) multiplicado por el grosor (d) del aislante. Las unidades para la resistencia son en el sistema internacional de unidades: (K·m²/W).
La fibra de vidrio rígida, un material aislante usado comúnmente, tiene un valor R de 4 por pulgada, mientras que el cemento, un mal conductor, tiene un valor de 0.08 por pulgada.
La efectividad de una barrera de radiación está indicado por su reflectividad, la cual es una fracción de la radiación reflejada. Un material con una alta reflectividad (en unalongitud de onda) tiene una baja absorbitividad, y por consiguiente una baja emisividad. Un reflector ideal tiene un coeficiente de reflectividad igual a 1, lo que significa que refleja el 100% de la radiación entrante. Por otro lado, en el caso de un cuerpo negro, el cual tiene una excelente absorbitividad y emitividad de la radiación térmica, su coeficiente de reflectividad es casi 0. Las barreras de radiación tiene una gran aplicación en ingeniería aeroespacial; la gran mayoría de los satélites usan varias capas aislantes aluminizadas que reflejan la luz solar, lo que permite reducir la transferencia de calor y controlar la temperatura del satélite.
Proceso termodinámico
En física, se denomina proceso termodinámico a la evolución de determinadas magnitudes (o propiedades) propiamente termodinámicas relativas a un determinado sistema termodinámico. Desde el punto de vista de la termodinámica, estas transformaciones deben transcurrir desde un estado de equilibrio inicial a otro final; es decir, que las magnitudes que sufren una variación al pasar de un estado a otro deben estar perfectamente definidas en dichos estados inicial y final. De esta forma los procesos termodinámicos pueden ser interpretados como el resultado de la interacción de un sistema con otro tras ser eliminada alguna ligadura entre ellos, de forma que finalmente los sistemas se encuentren en equilibrio (mecánico, térmico y/o material) entre sí.
De una manera menos abstracta, un proceso termodinámico puede ser visto como los cambios de un sistema, desde unas condiciones iniciales hasta otras condiciones finales, debido a la desestabilización del sistema.
TIPOS DE PROCESOS TERMODINÁMICOS
Procesos Iso
Son los procesos cuyas magnitudes permanecen "constantes", es decir que el sistema cambia manteniendo cierta proporcionalidad en su transformación. Se les asigna el prefijoiso-.
Ejemplo:
- Isotérmico: proceso a temperatura constante
- Isobárico: proceso a presión constante
- Isométrico o isocórico: proceso a volumen constante
- Isoentálpico: proceso a entalpía constante
- Isoentrópico: proceso a entropía constante
Procesos politrópicos
Los procesos politrópicos son aquellos procesos termodinámicos para gases ideales que cumplen con la ecuación:  donde
donde 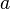 es un número dado. Para el caso de procesos adiabáticos,
es un número dado. Para el caso de procesos adiabáticos, 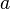 es igual a
es igual a 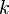 , el cual es un valor específico para cada sustancia. Este valor se puede encontrar en tablas para dicho caso.
, el cual es un valor específico para cada sustancia. Este valor se puede encontrar en tablas para dicho caso.
 donde
donde 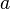 es un número dado. Para el caso de procesos adiabáticos,
es un número dado. Para el caso de procesos adiabáticos, 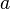 es igual a
es igual a 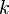 , el cual es un valor específico para cada sustancia. Este valor se puede encontrar en tablas para dicho caso.
, el cual es un valor específico para cada sustancia. Este valor se puede encontrar en tablas para dicho caso.Cantidad de calor
Cuando una sustancia se está fundiendo o evaporándose está absorbiendo cierta cantidad de calor llamada calor latente de fusión o calor latente de evaporación, según el caso. El calor latente, cualquiera que sea, se mantiene oculto, pero existe aunque no se manifieste un incremento en la temperatura, ya que mientras dure la fundición o la evaporación de la sustancia no se registrará variación de la misma.Para entender estos conceptos se debe conocer muy bien la diferencia entre calor y temperatura.
En tanto el calor sensible es aquel que suministrado a una sustancia eleva su temperatura.
La experiencia ha demostrado que la cantidad de calor tomada (o cedida) por un cuerpo es directamente proporcional a su masa y al aumento (o disminución) de temperatura que experimenta.
La expresión matemática de esta relación es la ecuación calorimétrica:
Q = m·Ce·(Tf-Ti)
En palabras más simples, la cantidad de calor recibida o cedida por un cuerpo se calcula mediante esta fórmula, en la cual m es la masa, Ce es el calor específico, Ti es la temperatura inicial y Tf la temperatura final. Por lo tanto Tf – Ti = ΔT (variación de temperatura).Nota: La temperatura inicial (Ti) se anota también como T0 o como t0.
Si Ti > Tf el cuerpo cede calor Q < 0
Si Ti < Tf el cuerpo recibe calor Q > 0
Se define calor específico (Ce) como la cantidad de calor que hay que proporcionar a un gramo de sustancia para que eleve su temperatura en un grado centígrado. En el caso particular del agua Ce vale 1 cal/gº C ó 4,186 J.
(Ver Tabla de calor específico para algunas sustancias)
Ver: Equlbrio termico
El calor específico puede deducirse de la ecuación anterior. Si se despeja Ce de ella resulta:

 |
| Si a 1 kg de hielo (a 0º C) le aplicamos 80 kcal obtendremos 1 kg de agua a 0º C. |
Calor latente de fusión
Para que un sólido pase al estado líquido debe absorber la energía necesaria a fin de destruir las uniones entre sus moléculas. Por lo tanto, mientras dura la fusión no aumenta la temperatura. Por ejemplo, para fundir el hielo o congelar el agua sin cambio en la temperatura, se requiere un intercambio de 80 calorías por gramo, o 80 kilocalorías por kilogramo.El calor requerido para este cambio en el estado físico del agua sin que exista variación en la temperatura recibe el nombre de calor latente de fusión o simplemente calor de fusión del agua.
Esto significa que si sacamos de un congelador cuya temperatura es de –6° C un pedazo de hielo de masa igual a 100 gramos y lo ponemos a la intemperie, el calor existente en el ambiente elevará la temperatura del hielo, y al llegar a 0° C y seguir recibiendo calor se comenzará a fundir.
A partir de ese momento todo el calor recibido servirá para que la masa de hielo se transforme en agua líquida. Como requiere de 80 calorías por cada gramo (ver cuadro), necesitará recibir 8.000 calorías del ambiente para fundirse completamente. Cuando esto suceda, el agua se encontrará aún a 0° C y su temperatura se incrementará sólo si se continúa recibiendo calor, hasta igualar su temperatura con el ambiente.
Calor de fusión de cada sustancia
El calor de fusión es una propiedad característica de cada sustancia, pues según el material de que esté hecho el sólido requerirá cierta cantidad de calor para fundirse. Por definición: el calor latente de fusión de una sustancia es la cantidad de calor que requiera ésta para cambiar 1 gramo de sólido a 1 gramo de líquido sin variar su temperatura.Los cálculos pertinentes se realizan utilizando las fórmulas:

Donde λf = calor latente de fusión en cal/gramo.
Q = calor suministrado en calorías.
m = masa de la sustancia en gramos.
En el cuadro siguiente se dan algunos valores del calor latente de fusión para diferentes sustancias.
Sustancia λf en cal/gr.
Agua 80
Hierro 6
Cobre 42
Plata 21
Platino 27
Oro 16
Mercurio 2,8
Plomo 5,9



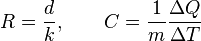
No hay comentarios:
Publicar un comentario